Redigering af generne for det menneskelige embryo kan have utilsigtede konsekvenser for menneskers sundhed og for samfundet som helhed. Derfor, da en kinesisk videnskabsmand brugte denne metode i et forsøg på at gøre børn mere modstandsdygtige over for HIV, var mange hurtige til at fordømme flytningen som for tidlig og uansvarlig. Naturen spurgte forskere, hvad der forhindrer denne procedure i at blive betragtet som en acceptabel klinisk praksis.
Forsøg på at foretage arvelige ændringer i det menneskelige genom har været kontroversielle. Her er, hvad du skal gøre for at gøre denne teknik sikker og acceptabel.
Seks måneder efter brylluppet besluttede Jeff Carroll og hans kone ikke at få børn. Carroll, en 25 år gammel tidligere amerikansk hærkorporal, lærte netop, at han har en mutation, der forårsager Huntingtons chorea, en genetisk lidelse, der skader hjernen og nervesystemet og altid fører til for tidlig død. For omkring fire år siden fik hans mor diagnosen sygdommen, og nu har han lært, at også han næsten helt sikkert vil blive syg.
Over for en 50% chance for at videregive den samme dystre skæbne til deres børn, besluttede parret, at børn var ude af spørgsmålet.”Vi har lige lukket emnet,” siger Carroll.
Mens han stadig var i hæren, begyndte han at studere biologi i håb om bedre at forstå sin sygdom. Han lærte, at der er en sådan procedure som genetisk præimplantation eller PGD. Carroll og hans kone kunne praktisk udelukke muligheden for mutationsoverførsel gennem in vitro-befrugtning (IVF) og embryodiagnostik. De besluttede at prøve lykken, og i 2006 fik de tvillinger uden Huntingtons mutation.
Carroll er nu forsker ved Western Washington University i Bellingham, hvor han anvender en anden teknik, der kan hjælpe par i hans situation: CRISPR genomisk redigering. Han har allerede brugt dette magtfulde værktøj til at ændre ekspressionen af genet, der er ansvarligt for Huntingtons sygdom i museceller. Fordi Huntingtons chorea kun er forårsaget af et gen, og dens konsekvenser er så ødelæggende, er det denne sygdom, der ofte nævnes som et eksempel på en situation, hvor redigering af gener i det menneskelige embryo - en procedure, der kan forårsage ændringer arvet af fremtidige generationer, og derfor er kontroversiel - virkelig kan være berettiget. Men udsigterne til at bruge CRISPR til at ændre dette gen i humane embryoner bekymrer stadig Carroll.”Dette er en enorm milepæl,” siger han. - Jeg forstår,at folk vil videregive det så hurtigt som muligt - inklusive mig. Men i denne sag skal alle ambitioner droppes. Proceduren kan have uforudsete konsekvenser for menneskers sundhed og for hele samfundet. Det vil tage årtier med forskning, før teknologien er sikker, sagde han.
Den offentlige mening om redigering af gener for at forhindre sygdom er generelt positiv. Men Carrolls tilbageholdenhed deles af mange forskere. Da nyheder brød sidste år om, at en kinesisk biofysiker brugte genomredigering for at forsøge at gøre børn mere modstandsdygtige over for HIV, var mange forskere hurtige til at fordømme flytningen som for tidlig og uansvarlig.
Siden da har flere forskere og videnskabelige samfund opfordret til et moratorium for redigering af det arvelige menneskelige genom. Men et sådant moratorium rejser et vigtigt spørgsmål, siger embryolog Tony Perry fra University of Bath, UK.”Hvornår kan det fjernes?” Siger han. - Hvilke betingelser skal der være opfyldt for dette?
Salgsfremmende video:
Naturen har spurgt forskere og andre interessenter, hvad der forhindrer genetisk redigering af at blive betragtet som en acceptabel klinisk metode. Visse videnskabelige problemer kan sandsynligvis overvindes, men det kan være nødvendigt at ændre kliniske forsøgspraksis og finde bredere enighed om teknologien for en metode, der skal certificeres.
Gå forbi målet: Hvor mange "fejl" kan du lave?
Genredigering er teknisk udfordrende, men hvad der har tiltrukket sig mest opmærksomhed er potentialet for uønskede genetiske ændringer, siger Martin Pera, en stamcelleforsker ved Jacksons Bar Harbor, Maine laboratorium. Alligevel tilføjer han, at dette er det problem, der sandsynligvis er det nemmeste at løse.
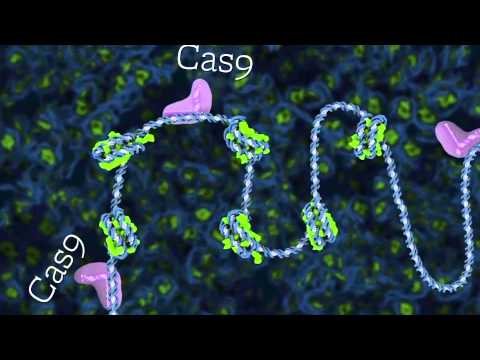
Den mest populære genredigeringsmetode er CRISPR-Cas9-systemet. Selve mekanismen er lånt fra nogle bakterier, der bruger den til at forsvare mod vira ved at skære DNA med Cas9-enzymet. En videnskabsmand kan bruge et stykke RNA til at dirigere Cas9 til en bestemt region i genomet. Som det viser sig, skærer Cas9 og lignende enzymer imidlertid DNA andre steder, især når der er DNA-sekvenser i genomet, der ligner det ønskede mål. Disse "side" -insnit kan føre til sundhedsmæssige problemer, såsom at ændre et gen, der hæmmer tumorvækst, kan føre til kræft.
Forskere har forsøgt at udvikle alternativer til Cas9-enzymet, der måske er mindre tilbøjelige til fejl. De udviklede også versioner af Cas9, der giver en lavere fejlhastighed.
Fejlfrekvensen varierer afhængigt af hvilken region i genomet enzymet er målrettet mod. Mange genredigerende enzymer er kun blevet undersøgt hos mus eller humane celler dyrket i kultur, ikke i humane embryoner. Fejlfrekvensen kan være forskellig i mus- og humane celler såvel som i modne og embryonale celler.
Fejltællingen behøver ikke at være nul. En lille mængde DNA-ændringer forekommer naturligt hver gang en celle deler sig. Nogle siger, at visse baggrundsændringer kan være acceptable, især hvis metoden bruges til at forhindre eller behandle en alvorlig sygdom.
Nogle forskere mener, at CRISPR-fejlfrekvensen allerede er lav nok, siger Perry.”Men - og jeg synes, dette er et temmelig stort” men”- vi har endnu ikke fundet ud af detaljerne i redigering af menneskelige æg og embryoner endnu,” sagde han.
Mål, men ikke så: hvor nøjagtig skal genomisk redigering være?
Et større problem end bivirkninger kan være DNA-ændringer, der er målrettede, men uønskede. Efter at Cas9 eller et lignende enzym skærer DNA'et, overlades cellen til at heles såret. Men celle-reparationsprocesser er uforudsigelige.
En form for DNA-reparation eller -reparation er ikke-homolog ende-vedhæftning, der fjerner nogle af DNA-bogstaverne ved udskæringen - en proces, der kan være nyttig, hvis målet med redigering er at slukke udtrykket af et mutant gen.
En anden form for reparation, kaldet homolog reparation, giver forskere mulighed for at omskrive DNA-sekvensen ved at tilvejebringe en prøve, der kopieres på stedet for udskæringen. Det kan bruges til at korrigere en tilstand, såsom cystisk fibrose, som normalt er forårsaget af en deletion (tab af en del af et kromosom) i CFTR-genet.
Begge processer er vanskelige at kontrollere. Sletninger forårsaget af ikke-homolog slutforbindelse kan variere i størrelse og danne forskellige DNA-sekvenser. Homolog reparation giver mulighed for bedre kontrol over redigeringsprocessen, men den forekommer meget sjældnere end sletninger i mange celletyper. Undersøgelser med mus kunne gøre CRISPR genomisk redigering mere nøjagtig og effektiv, end det er nu, siger Andy Greenfield, en genetiker ved Harwell Institute i det britiske medicinske forskningsråd nær Oxford. Mus avler store afkom, og derfor har forskere mange forsøg på at opnå vellykket redigering og slippe af med alle fejl. Det samme kan ikke siges om menneskelige embryoner.
Det er endnu ikke klart, hvor effektiv målrettet homolog reparation vil være hos mennesker, eller endda hvordan nøjagtigt den vil fungere. I 2017 brugte en gruppe forskere CRISPR-Cas9 i humane embryoner til at korrigere genvarianter forbundet med hjertesvigt. Embryoerne blev ikke implanteret, men resultaterne viste, at de modificerede celler blev brugt som en skabelon til DNA-reparation med mors genom snarere end den DNA-skabelon, som forskerne leverede. Dette kan vise sig at være en mere pålidelig måde at redigere DNA fra menneskelige embryoner. Men siden da har andre forskere rapporteret, at de ikke har været i stand til at gentage disse resultater. "Vi forstår endnu ikke helt, hvordan DNA-reparation forekommer i embryoner," siger Jennifer Doudna, en molekylærbiolog ved University of California, Berkeley.”Vi er nødt til at arbejde meget med andre typer embryoner for at forstå i det mindste basale ting.”
Forskere udvikler måder til at løse problemerne forbundet med DNA-reparation. To artikler, der blev offentliggjort i juni, diskuterer CRISPR-systemet, som kan indsætte DNA i genomet uden at forstyrre begge strenge og dermed omgå afhængighed af DNA-reparationsmekanismer. Hvis systemerne med succes gennemgår yderligere test, kan de muligvis give forskere bedre kontrol over redigeringsprocessen.
En anden tilgang er at bruge en teknik kaldet grundlæggende redigering. De grundlæggende redaktører indeholder en deaktiveret Cas9 sammen med et enzym, der kan konvertere et bogstav af DNA til et andet. Den handicappede Cas9 leder baseditoren til et afsnit af genomet, hvor det kemisk modificerer DNA direkte uden at skære det. Forskning offentliggjort i april viste, at nogle af disse basale redaktører også kan foretage utilsigtede ændringer, men arbejdet fortsætter med at forbedre deres nøjagtighed.
"Grundlæggende redigering opfylder ikke i øjeblikket vores kriterier," siger Matthew Porteus, en pædiatrisk hæmatolog ved Stanford University i Californien. "Men du kan forestille dig, at det bliver bedre med tiden."
Læs fortsættelsen her.
Heidi Ledford